Das Ziel einer Operation bei Lungenkrebs ist die definitive Heilung, die in der Vergangenheit nicht immer gelungen ist. Es braucht Therapien, die der Operation helfen, den langfristigen Erfolg zu stärken. Prim. Dr. Markus Rauter vom Klinikum Klagenfurt Wörthersee erklärt in einem Webinar der Österreichischen Lungenunion, dass es genau hierfür verschiedene Arten der Therapie des nicht kleinzelligen Lungenkarzinoms gibt: Neoadjuvante und adjuvante Therapieformen.
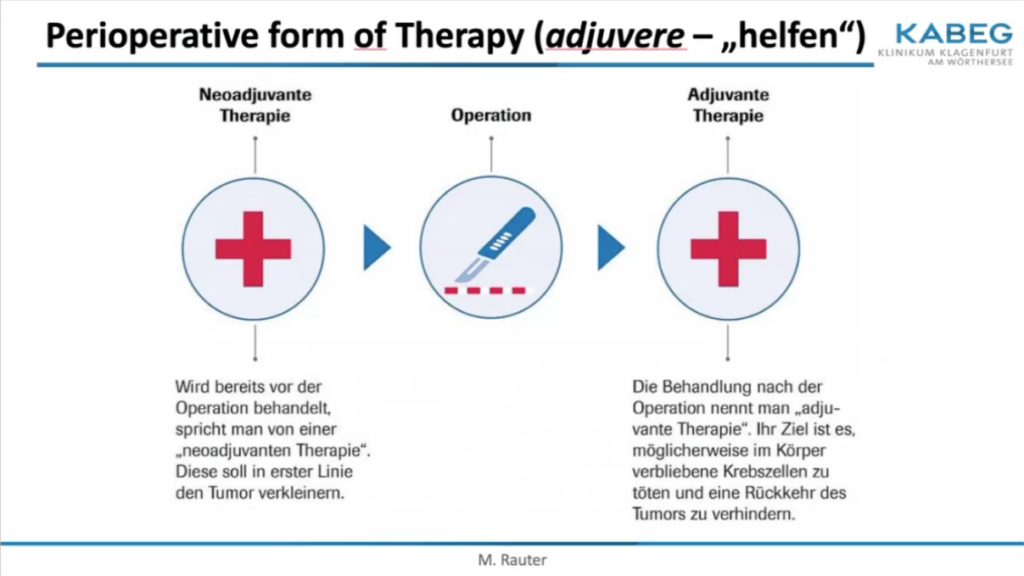
Von einer neoadjuvanten Therapie wird gesprochen, wenn bereits vor der Durchführung der Operation (perioperativ) eine systemische Therapie verabreicht wird. Diese sollte in erster Linie den Tumor verkleinern und in weiterer Folge die Operabilität des Tumors ein wenig erleichtern.
Im Zuge einer adjuvanten Therapie werden an Lungenkrebs erkrankte Personen primär operiert und im Anschluss mit einer systemischen Therapie nachbehandelt, um möglicherweise im Köper verbliebe Krebszellen abzutöten. Diese Krebszellen kann man in vielen Fällen nicht nachweisen, da es sogenannte Mikrometastasen sein können. Doch aufgrund der wissenschaftlichen Entwicklung kann zirkulierende Tumor-DNA in vielen Fällen gemessen werden. „Das sind einfach kleine DNA-Bestandteile aus der Tumorerkrankung, die ins Blut ausgeschwemmt werden, die man mit modernen Methoden nachweisen kann.“, so der Experte. Das ist wichtig, denn ein Nachweis der zirkulierende Tumor-DNA-Bestandteile im Blut bedeutet für Patient:innen ein hohes Risiko für ein Rezidiv ihrer Erkrankung, also einem Wiederauftreten der Lungenkrebserkrankung. Zwar ist diese Methode noch nicht standardisiert und für die breite Masse zugänglich, aber Prim. Dr. Rauter ist zuversichtlich, dass diese Messung eines Tages in die klinische Routine implementiert wird.
Die Heterogenität der Lungenkrebserkrankung
Mittlerweile sind sehr viele Unterarten von Krebsformen bekannt, die biologisch so verschieden sind, dass es sich kaum noch um eine Krankheitsentität handelt. Um es in den Worten von Prim. Dr. Rauter auszudrücken: „Man kann fast schon von Lungenkrebserkrankungen sprechen“. So ist die alte Einteilung in kleinzelliges und nicht kleinzelliges Karzinom längst überholt, ebenso die Aufteilung in die beiden Hauptformen Adenokarzinom und Plattenepithelkarzinom des nicht kleinzelligen Lungenkarzinoms. Vielmehr sollten die Karzinome weiter in Treibermutationen aufgeteilt werden, die insbesondere beim Adenokarzinom nachgewiesen werden können. Bei treibermutierten Tumoren kommen sogenannte zielgerichtete Therapieformen zum Einsatz, die in den meisten Fällen peroral als Tablettentherapie appliziert werden. Die zielgerichtete Therapieform wirkt über viele Jahre und ist äußerst nebenwirkungsarm. Auch hier gibt es die Möglichkeit einer perioperativen Therapie.
Ansatz der Immuntherapie
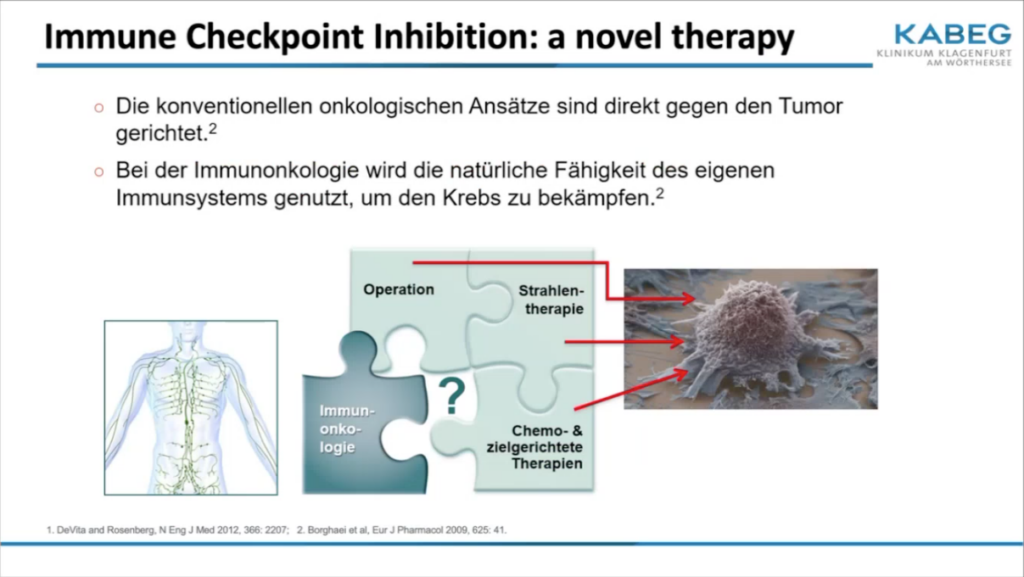
Konventionelle Ansätze, wie die Strahlen- oder Chemotherapie, sind grundsätzlich unmittelbar gegen den Tumor gerichtet. Sie zielen darauf ab, den Tumor direkt abzutöten. Bei der Strahlentherapie muss versucht werden, die maximale Strahlendosis exakt auf den Tumorkern zu bündeln. „Bei der Chemotherapie gelingt das nicht, das ist eine Art Schrotschuss gegen alle schnellteilenden Gewebetypen und dadurch hat man auch Nebenwirkungen wie Unterdrückungen des Blutbildes, Haarausfall, Übelkeit, Durchfall etc.“, erläutert Prim. Dr. Rauter.
Die Immuntherapie hingegen fokussiert sich darauf, dass ein im Körper wachsender Tumor Antigene freisetzt. Diese sind Bestandteile des Tumors, die der Körper nicht kennt und somit das eigene Immunsystem aktivieren. Das Immunsystem funktioniert über sogenannte T-Zellen, die zum Tumor wandern und den Tumor abtöten. Nun haben Tumore über die Interaktion der PD-L1, PD-1 Achse die Möglichkeit, die Aktivierung des Immunsystems zu blockieren und damit einer Abtötung zu entgehen. Das ist der Immunonkologie bewusst und so wird ein Antikörper zwischen die aktive T-Zelle und die Tumorzelle gelegt. Mithilfe dieser Blockierung der PD-1 Achse kann die T-Zelle die Tumorzelle abtöten.
Wirkung der Immuntherapie
Die Immuntherapie wirkt besser, wenn die Tumorzellen diesen PD-L1 Rezeptor an der Zelloberfläche exprimieren. Etwa ein Drittel aller Patient:innen hat eine sehr hohe PD-L1 Expression, ein weiteres Drittel weist eine mäßige PD-L1 Expression auf und ein Drittel der Tumorpatient:innen beim nichtkleinzelligen Lungenkarzinom ist PD-L1 negativ. Die Gesamtansprechraten der Immuntherapie sind zwar bei PD-L1 negativen Patient:innen geringer, als bei Patient:innen, die den Rezeptor in einem hohe Maß an der Tumorzelloberfläche ausdrücken, doch auch hier kann eine Immuntherapie Erfolg bringen.
Prim. Dr. Rauter zeigt die Erfolge der Immuntherapie in Kombination mit einer Chemotherapie anhand der StudieKEYNOTE – 189 mit metastierten Patient:innen im Stadium 4: Während das mittlere Überleben im Rahmen einer Chemotherapie bei in etwa zehn bis elf Monaten liegt, leben Patient:innen durch Hinzugabe einer Immuntherapie im Schnitt 22 Monate. Jede:r fünfte Patient:in ist nach fünf Jahren noch am Leben, bei der Chemotherapie ist das nur in etwa jede:r neunte. „Die Studie verdeutlicht außerdem, dass Patienten, die PD-L1 negative Tumore haben, auch von der Hinzugabe der Immuntherapie profitieren, aber nicht so ausgeprägt wie die Patienten, die eine hohe PD-L1 Expression haben. Hier ist das 5-Jahresüberleben 30%. Mit der PD- L1 Negativität waren es 10%. Also da sieht man schon klare Unterschiede. Dennoch auch hier ein Vorteil gegenüber der Chemotherapie.“, so der Experte.
Heilungschancen in Frühstadien
Die Überlebensraten bei Patient:innen in frühen Stadien der Lungenkrebserkrankung sind im Sinne eines kurativen Settings noch nicht befriedigend: Im Stadium 1B der Lungenkarzinomerkrankung mit einer Tumorgröße von zwei bis drei Zentimetern und keiner Metastasierung beträgt das 5-Jahresüberleben 65 bis 75%. Im Stadium 3A, hier sind Patient:innen mit einem Befall der Lymphknoten inkludiert, befindet sich das 5-Jahresüberleben bei 30 bis 45%. Wird hier adjuvant, also nach der Operation, eine Chemotherapie eingesetzt, zeigen Metaanalysen, dass der Vorteil im 5-Jahresüberleben lediglich bei 5,4% liegt. Die Chemotherapie ist in diesem Setting nicht zielführend.
Die wissenschaftlichen Daten zur Immuntherapie versprechen schönere Ergebnisse, wie die sogenannte IMpower010 – Studie zeigt: Hier wurden Lungenkrebspatient:innen mit einer Tumorgröße von vier Zentimetern beziehungsweise einem Lymphknotenbefall operiert. Anschließend wurde eine Chemotherapie und danach ein Jahr lang Atezolizumab als Immuntherapie oder eine sogenannte Best-Supportive-Care (Behandlung ohne Medikation) verabreicht. Für die Tumorstadien 2 bis 3A liegt eine Hazard Ration von 0,43 vor. Das bedeutet, dass eine Reduktion von 57% des Erkrankungsrückfalles gegeben ist. Die Daten zum Gesamtüberleben zeigen immerhin ein 5-Jahresüberleben von 85%. Hinzugefügt sei jedoch, dass das ausschließlich für die etwas kleinere Gruppe der PD-L1 hoch exprimierenden Patient:innen funktioniert und zugelassen ist. Subgruppenanalysen verdeutlichen eine besonders gute Wirkung beim Vorliegen eines Lymphknotenbefalls.
Die zweite Studie CheckMate 816 verfolgt nun ein neoadjuvantes Setting: Es wurde nicht wie zuvor eine einjährige Therapie im Anschluss an eine Operation gegeben. Ein Jahr ist ein sehr langes Intervall und für Patient:innen belastend. Hier wurden also lediglich drei Zyklen, allerdings von einer Kombination der Immuntherapie mit Nivolumab und Chemotherapie, verabreicht. Dies geschah vor der Operation, welche optimalerweise innerhalb von sechs Wochen erfolgte. Verglichen wird dies mit der alleinigen Chemotherapie, welche ebenfalls für drei Zyklen verabreicht wurde.
Erfreuliche Daten
Den Endpunkt bildete entweder die pathologisch komplette Remission, davon wird gesprochen, wenn nach der Therapie keine vitalen Tumorzellen mehr vorhanden sind oder aber die Major Pathological Response, wo 90% der Tumorzellen im ehemaligen Tumorbett abgestorben sind. Prim. Dr. Rauter meint: „Man sieht absolut erfreuliche Daten. So eine Major Pathological Response konnte bei 37% der Patienten erzielt werden und bei knapp jedem vierten Patienten gelang es sogar, alle Tumorzellen mit nur drei Zyklen dieser neoadjuvanten Therapie abzutöten.“ Nach zwei Jahren haben 65% der Patient:innen kein Krankheitsrezidiv erlitten. Auch hier gibt es wieder einen klaren Zusammenhang mit dem PD-L1 Status. Der Zulassungstext der EMA schließt alle PD-L1 positiven Patient:innen ein.
Es besteht außerdem ein Zusammenhang mit dem Tumorstadium. Prim. Dr. Rauter betont: „Je höher das Tumorstadium ist, umso notwendiger ist eine perioperative, in diesem Fall neoadjuvanten Behandlung, für einen großen Benefit. Natürlich ist eine Kombination von Chemo- mit Immuntherapie mit potenziellen Nebenwirkungen behaftet, aber speziell im Stadium 3A muss alles daran gesetzt werden, dass den Patient:innen diese Therapieform zukommt.“ Die Daten zum Gesamtüberleben zeigen ab einer Nachbeobachtungszeit von drei Jahren einen großen Unterschied zwischen den Therapieformen, der deutlich zugunsten der Immuntherapie ausfällt.
Neoadjuvante vs. adjuvante Krebstherapie
Die neoadjuvante Therapie hat den Vorteil, dass sie kürzer ist, und der Tumor als „Antigenquelle für die Immuntherapie“ noch in situ ist. Möglicherweise nachteilhaft ist die eventuelle Verzögerung der Operation. Einzelne Patient:innen sprechen gegebenenfalls nicht auf die neoadjuvante Therapie an oder erleiden relevante Nebenwirkungen und können hinterher nicht mehr operiert werden. Die adjuvante Therapie hingegen führt Patient:innen auf schnellstem Wege zur Operation. Von Nachteil sind hier jedoch der sehr viel längere Verabreichungszeitraum und eine hohe Drop-Out-Rate.
Eine Entscheidung zwischen den beiden Therapieformen muss allerdings nicht zwangsläufig getroffen werden. Aktuelle Studien, die in Bälde zu einer Zulassung führen werden, kombinieren die beiden Therapien. Die AEGEAN – Studie zeigt eine Kombination von Chemotherapie mit einer Immuntherapie. Für vier Zyklen wurde die Immuntherapie, hier Durvalumab, verabreicht, gefolgt von der Operation mit anschließender Gabe der Immuntherapie im vierwöchigen Intervall für 12 Zyklen, also ein Jahr lang postoperativ. Die Daten sind vielversprechend: Das krankheitsfreie Überleben nach zwei Jahren liegt bei 63%, ähnlich der neoadjuvanten Studie. Die Remissionsrate ist etwas niedriger, aber da nie dieselbe Studienpopulation untersucht wird, sind die einzelnen Studien nicht direkt vergleichbar.
„Gute wissenschaftliche Evidenz“
Auch die Studie KEYNOTE – 671 wird zeitnah zu einer Zulassung führen. Das Studiendesign zeigt eine Chemotherapie mit Immuntherapie für vier Zyklen präoperativ, danach die Operation und im Anschluss für ein Jahr lang eine Immuntherapie. Die Daten zum krankheitsfreien Überleben sind hier ebenfalls schön und weisen ein 2-Jahresüberleben von 62% auf. „Das freut uns immer, wenn wir verschiedene Studien haben, die sehr ähnliche Ergebnisse zu Tage fördern. Denn dann muss man doch davon ausgehen, dass diese Daten nicht dem Zufall entspringen, sondern, dass es sich um sehr gute wissenschaftliche Evidenz handelt.“, so der Experte. In diesen Studien kamen 15-20% der Patient:innen aufgrund der neoadjuvanten Therapie nicht zur Operation. Zwar wurden einige davon außerhalb der Studie operiert, aber es ist wichtig, dies für die Wahl der Therapie mit den Patient:innen zu beachten.

Was wir nicht wissen
Aktuell ist unklar, ob eine Fortsetzung der Immuntherapie für ein Jahr lang, wie in den Studien untersucht, notwendig ist. Möglicherweise reichen drei Zyklen, wie in der CheckMate 816 – Studie gezeigt. Vielleicht ist ein Jahr aber auch zu kurz. Auch die Biomarker, beispielsweise die zirkulierende Tumorzell-DNA, bedürfen noch an Erforschung. Womöglich werden andere Formen der Immuntherapie oder sogenannte Angiogenesehemmer gebraucht. Eventuell müssen perioperativ Antikörper-Wirkstoff-Konjugate, neue Wirkstoffansätze, sowie eine Bestrahlung mitkombiniert werden. In diesem Feld der pneumoonkologischen Fragestellungen wird momentan intensiv geforscht.
Die zielgerichtete Therapie
Bei den Adenokarzinomen haben in etwa 16% der Patient:innen der Kaukasier eine „klassische“ EGFR – Mutation namens Deletion 19 oder L858R. In der ADAURA – Studie wurden solche EGFR-positiven Patient:innen operiert und konnten anschließend eine adjuvante, also postoperative Chemotherapie bekommen, was aber nicht bei allen der Fall war. Danach wurde für drei Jahre eine zielgerichtete Therapie mit dem Tyrosinkinasehemmer Osimertinib verabreicht. Die ersten Ergebnisse sind sehr vielversprechend. Nach Beendigung der dreijährigen Behandlung, sind 90% der Patient:innen krankheitsfrei. Zum Vergleich: Nach 28 Monaten hat bereits die Hälfte der Patient:innen ohne Wirkstoff einen Krankheitsrückfall. Allerdings steigt nach dem Ende der Behandlung mit Osimertinib das Rückfallrisiko stark an. Das zeigen auch andere Studien. Vielleicht ist es nicht geschickt, nach den drei Jahren mit Osimertinib aufzuhören.
Daten zum Gesamtüberleben zeigen eine Reduktion eines tödlichen Ereignisses um 51%, somit ein sehr großes Ausmaß an Überlebensverlängerung. Auch die Gruppe ohne Chemotherapie profitiert, was für die Lebensqualität der Patient:innen entsprechend vorteilhaft ist.
In der NeoADAURA – Studie wird ein neoadjuvantes Setting erforscht: Unter Umständen ist es besser, die zielgerichtete Therapie bereits vor der Operation geben. Auch hier sind also noch viele Fragestellungen offen, auf die es hoffentlich in nächster Zeit erste Antworten geben wird. „Das Kapitel der perioperativen Therapie bei Lungenkrebserkrankungen ist sicherlich noch lange nicht zu Ende geschrieben.“, so Prim. Dr. Rauter abschließend.
Webinar im September 2023 mit Prim. Dr. Markus Rauter vom Klinikum Klagenfurt Wörthersee, Vorstand der Pulmologie.